我国科学家首次解析糖蛋白激素机制,临床开发小分子药物有望替代激素治疗
科技日报记者 王春
9月22日,中国科学院上海药物研究所徐华强/蒋轶团队,联合浙江大学张岩团队,在《自然》杂志上发表最新研究成果,首次解析了糖蛋白激素GPCR,即全长黄体生成素/绒毛膜促性腺激素受体(简称LHCGR)处于失活状态和多种激活状态下的四个结构。
该研究揭示了绒毛膜促性腺激素(CG)识别LHCGR的分子机制,揭示了1期临床实验的小分子化合物Org43553与受体LHCGR相互作用细节模式;鉴定了糖蛋白激素选择性结合LHCGR和促卵泡激素(简称FSH)受体的关键氨基酸残基;提出了激素配体激活受体的“Push and Pull”模型。研究对理解糖蛋白激素识别和激活GPCR的机制,为临床开发替代激素治疗的小分子药物具有重要的理论和现实意义。

糖蛋白激素结构模式图及LHCGR受体与CG和Gs蛋白复合物的冷冻电镜结构。受访者供图
激素是人体的化学信使,控制着各个器官的生理功能,而下丘脑和脑下垂体是内分泌激素的控制中心。传统内分泌系统由三大分支组成,即下丘脑-垂体-性腺轴(HPG)、下丘脑-垂体-甲状腺轴(HPT)和下丘脑-垂体-肾上腺轴(HPA)。其中,三种促性腺激素,包括促黄体生成素(简称LH),促卵泡激素(简称FSH)和绒毛膜促性腺激素(简称CG)是糖蛋白激素,调控HPG轴的关键生理功能,包括人体的性别发育,精子发生和卵子成熟,以及促进第二性特征的发育及维持。另一类糖蛋白激素促甲状腺激素(简称TSH)是HPT轴调节的关键糖蛋白激素,主要通过调控机体甲状腺素的水平从而调节人体代谢。
四种糖蛋白激素的整体三维结构高度相似,均由一条保守的α链和激素特异性的β链组成。糖蛋白激素受体为A类G蛋白偶联受体(简称GPCR),其中,LH和CG共同作用于促黄体生成素/绒促性素受体(LHCGR),FSH作用于卵泡刺激素受体(FSHR),TSH作用于促甲状腺激素受体(TSHR)来发挥生理功能。与大多数A类GPCR不同,糖蛋白激素受体有约由340-420个氨基酸构成的巨大N端胞外区结构域(ECD),该结构域由富含亮氨酸的重复序列构成,且存在复杂的糖基化修饰。铰链区连接受体的ECD和跨膜区构成全长受体。
联合研究团队采用单颗粒冷冻电镜技术,解析了3个近原子分辨率的全长LHCGR处于激活状态下的结构,包括结合内源性激素CG的LHCGR(野生型)受体结构(4.3埃)、结合内源性激素CG的LHCGR(含持续性激活突变S277I)受体结构(3.8埃)以及结合内源性激素CG和小分子化合物Org43553的LHCGR(含持续性激活突变S277I)受体结构(3.2埃)。
研究首次揭示了全长LHCGR的结构,以及CG与LHCGR相互作用的细节。研究人员通过大量尝试,克服了全长失活受体构象高度不稳定的技术难题,最终解析了失活状态下全长LHCGR的电镜结构,分辨率为3.8埃。通过对比激活LHCGR结构,研究人员发现受体的ECD发生了大约45度的偏转。经过进一步结构分析和功能试验验证,最终提出了LHCGR受体“Push and Pull”的受体激活模型,这也是第一个全长单独GPCR的电镜结构。
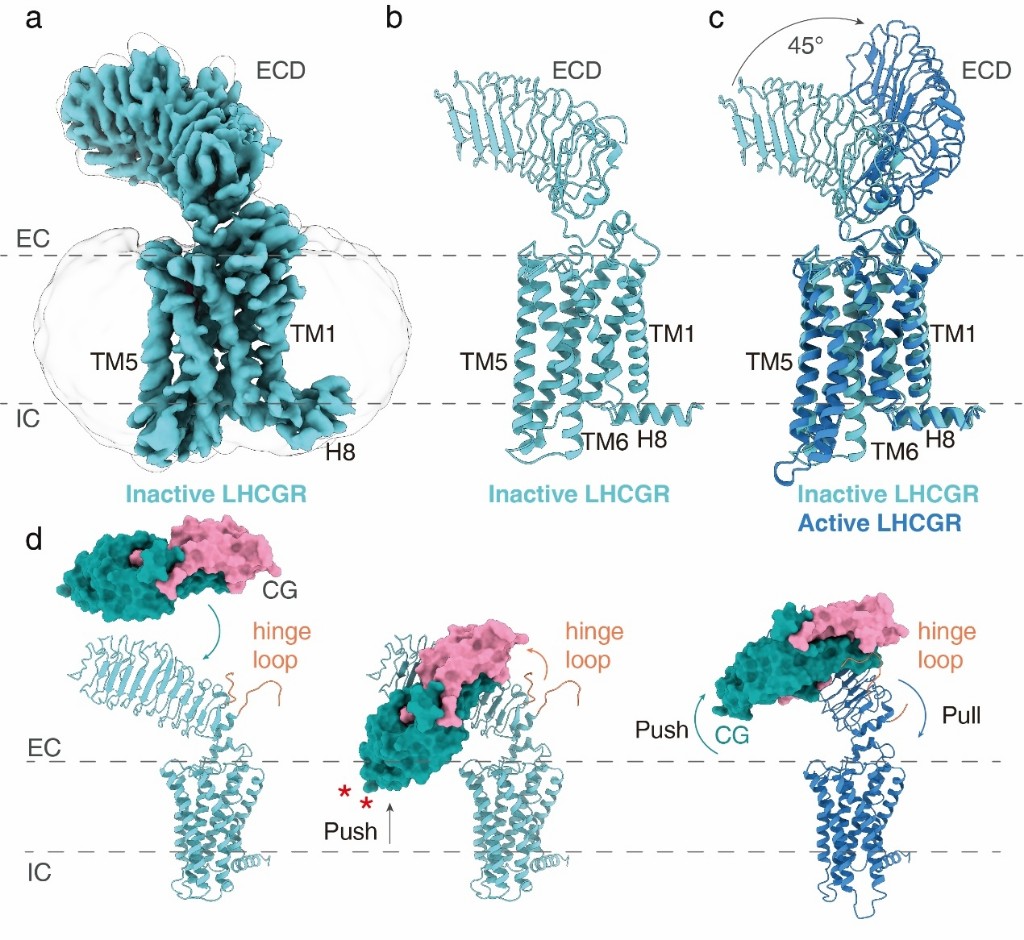
LHCGR失活状态电镜结构与激活状态结构比较以及受体激活模型。受访者供图
此外,研究人员还解析了处于1期临床试验中的小分子化合物Org43553与LHCGR相互作用的分子细节,揭示了Org43553的结合口袋,为临床开发针对LHCGR,FSHR和TSHR的选择性小分子药物替代激素治疗提供了重要的结构模板。